國璽專欄
2024/09/02
細胞治療新藥:從開發到上市
細胞治療新藥從研發到上市的過程通常比傳統小分子藥物更加複雜和嚴格。
主要原因包括:
1. 基礎研究:需要深入研究幹細胞的生物學特性、分化能力、風險和治療潛力。
2. 細胞篩選:需要篩選不同來源的幹細胞,與選定合適的細胞來源,並確保其質量和安全性。
3. 臨床前研究:在進行人體試驗前,必須通過動物實驗評估幹細胞療法的安全性和有效性,包括其分化能力和潛在的免疫排斥反應。
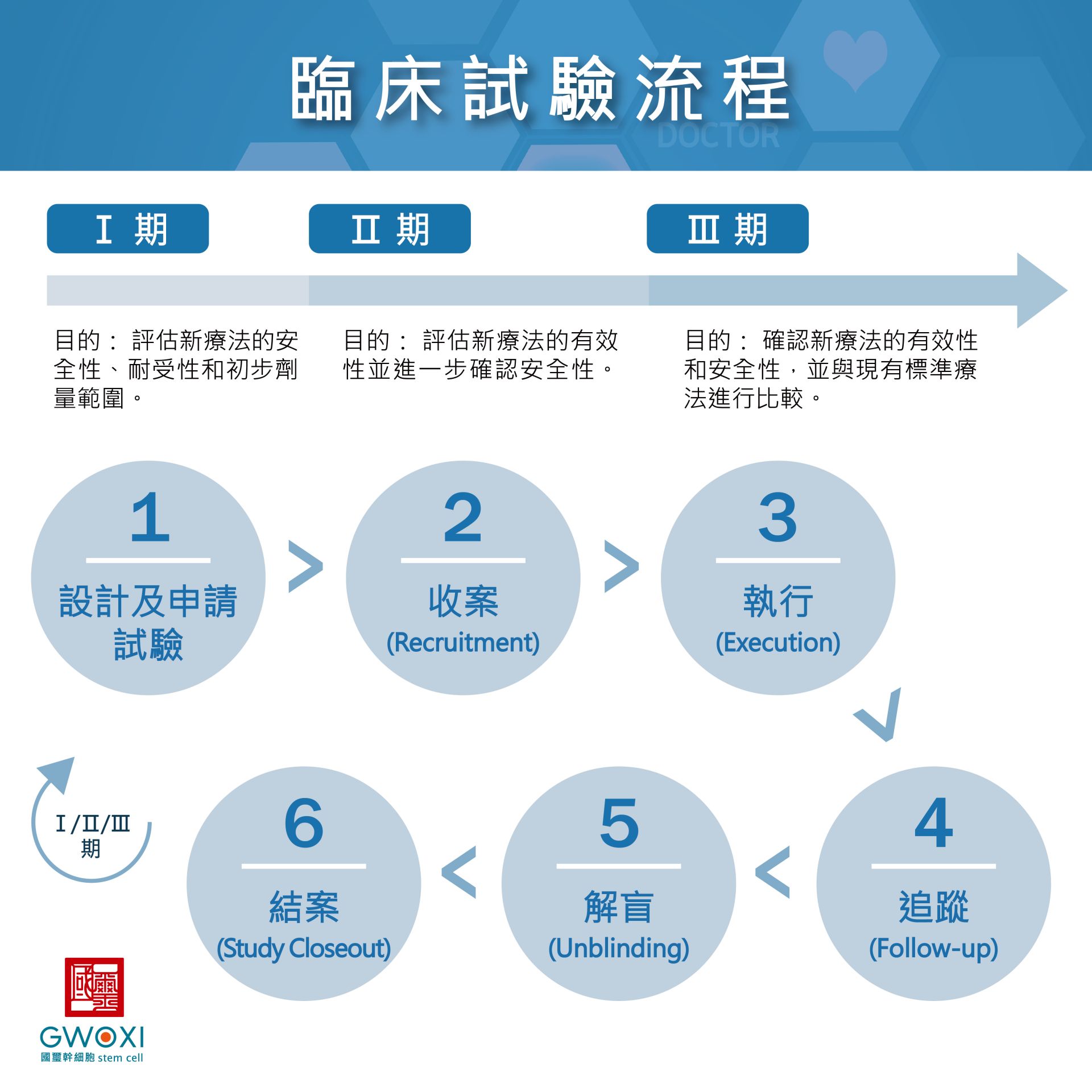
4. 縝密的臨床試驗計畫:
I期:測試安全性和耐受性。
II期:評估初步有效性並進一步測試安全性。
III期:在更大規模患者中驗證療法的有效性和安全性,並長期觀察其效果和潛在風險。
流程:設計及申請實驗→收案→執行→追蹤→解盲→結案
5. 監管審批:細胞治療屬於新興醫療技術,監管審查非常嚴格,需要提供詳盡的數據和質量控制信息,審批過程通常更耗時。
6. 生產和質量控制:臨床細胞的生產需要嚴謹管控與高端技術要求,確保每批次幹細胞符合嚴格的質量標準。
7. 市場推廣與長期監測:細胞治療產品上市後,需要推廣並進行長期監測,以確保其安全性和有效性。
正因為細胞治療的科學、技術和倫理問題比傳統藥物更複雜,使細胞治療臨床試驗受到監管單位更嚴格的審查。

參考資料
- Ciervo Y, Ning K, Jun X, Shaw PJ, Mead RJ. Advances, challenges and future directions for stem cell therapy in amyotrophic lateral sclerosis. Mol Neurodegener. 2017 Nov 13;12(1):85. doi: 10.1186/s13024-017-0227-3.
- Abolarinwa BA, Shaw MK, Lee CH. Perspectives on Challenges to Cell Therapy Development in Taiwan: Strengthening Evidential Standards and Ways Forward. Front Bioeng Biotechnol. 2021 Dec 16;9:789043. doi: 10.3389/fbioe.2021.789043.
- Liras A. Future research and therapeutic applications of human stem cells: general, regulatory, and bioethical aspects. J Transl Med. 2010 Dec 10;8:131. doi: 10.1186/1479-5876-8-131.
- 衛生福利部「我國新藥與疫苗研究開發、上市流程及相關法規之妥適性」
